为什么银染实验要用EDI水?
SDS聚丙烯酰胺凝胶染色是蛋白质研究的一个基础方法。染色方法有很多,实际应用中,考马斯亮蓝染色(考染)和银染是运用的最多的方法。考马斯亮蓝G250在游离状态下呈红色,它与蛋白质结合后变为蓝色,结合物在595 nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
银染实验中,在碱性条件下,银离子被还原成金属银,沉淀在蛋白质的表面上显色。蛋白电泳后的 SDS-聚丙烯酰胺凝胶在甲醇溶液中浸泡后,水洗后用硝酸银溶液银染,再水洗后用碳酸钠甲醇水溶液显色。
与考染相比,银染具有灵敏度高的优点,很多做环境、植物、育种等方面的客户,都会做银染方面的实验。银染对于试剂的要求比较高,尤其对其中使用纯水的水质要求比较高。
一、仪器和试剂
乙酸(1%),显影液(2.5%碳酸钠和0.02%甲醛水溶液),乙醇(30%),固定液(乙醇:冰醋酸:水(30:10:60)),硝酸银溶液(0.1%),显影液(将溶液A在850 mL去离子水中加入37 g NaCl和37 g CuSO4,再加入浓氨水直到深蓝色沉淀形成然后溶解,定容至1 L)和溶液B(在900 mL去离子水中加入436 g 硫代硫酸钠,定容至1 L)混合,加三倍水稀释,立即使用
二、试验方法
1. 通过SDS-聚丙烯酰胺凝胶电泳分离蛋白质;
2. 将凝胶浸泡在至少5倍体积的固定液中,室温下平缓摇动4 - 12 h,使蛋白固定;
3. 弃去固定液,加至少5倍体积的30%乙醇,室温下平缓摇动30 min;
4. 重复步骤3;
5. 弃去乙醇,加10倍体积的纯水(去离子水),室温下平缓摇动10 min;
6. 重复步骤5两次;
7. 弃去清洗用水,加5倍体积的硝酸银溶液,室温下平缓摇动30 min;
8. 弃去硝酸银溶液,用纯水(去离子水)漂洗凝胶两面,每面20 s;
9. 加5倍体积的新鲜显影液,室温下平缓摇动,数分钟内出现蛋白质的染色条带,继续至条带清晰;
10. 用1%乙酸清洗凝胶终止反应,再用纯水(去离子水)水漂洗数次,每次10 min。
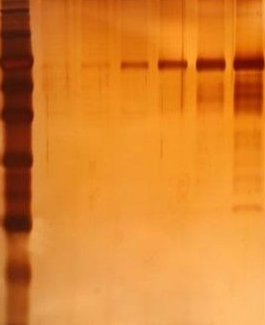
银染后的凝胶可以通过凝胶成像系统或扫描仪转化为照片,或者可以直接用手机拍摄。
在银染实验中,纯水(去离子水)水质非常重要,对实验成功与否起着关键性的作用。有用户在实验中忽略了这一点,纯水水质不佳,导致氯离子含量超标,浸泡时出现硝酸银沉淀,沉淀在胶上,最后显影的时候看到的是一片花花的乱象,影响了染色效果。
氯化银的溶解度通常是2 ppm,氯离子是水中常见的一种离子杂质,如果水中的氯离子超过2 ppm,即有可能出现杂质,也就是说,对于银染实验,对于纯水质量的要求还是比较苛刻的,一般的反渗透纯水(RO)设备,还难以达到要求。
另外,水中的颗粒物也会吸附银离子沉淀显色,污染背景,甚至让好好的凝胶成了“大花脸”。因此制备出来的纯水在使用前,还应该通过0.22或0.45μm的过滤器预先过滤,以去除水中的颗粒物。
专业来讲,银染用水应该尽量选用符合国标《分析实验室用水规格和试验方法》(GB/T 6682-2008二级纯水以上的水—电导率至少应当在 1 μS/cm以下。
因此,银染用水应当使用EDI纯水或者超纯水,而RO 纯水是不能满足银染用水需求。

国内做实验室EDI纯水设备的厂家很少。渗源是国内最早生产EDI实验室纯水设备的供应商。渗源新一代SYH智能型一体化超纯水系统可以同时制备EDI 纯水和超纯水。SYH生产的 EDI 纯水水质完全满足银染实验,还可以用来配制其他相关实验的试剂;超纯水可以应用于银染实验的上下游以及其他蛋白质研究实验,例如蛋白SDS-PAGE电泳、Western Blotting等。取水终端安装的终端微滤器,可以制备无热原(内毒素)、核酸酶、细菌的超纯水,用于生化分析和分子生物学。
同类文章排行
- 超纯水机ro和up的ph值一般
- 实验室超纯水机RO膜哪个是
- 电导率和电阻值之间如何
- 超纯水机的电阻值多少范
- 树脂的寿命一般是多久?
- 纯水机中的废水比的工作
- 2020版中国药典纯化水要求
- 实验室动物饮用水标准有
- 实验室17种有毒试剂介绍
- 超纯水机ro水和up水的区别

